Soframızda Tuzken Nükleer Tesislerin de Vazgeçilmezi Olan Element: Sodyum

üretimi oldukça zahmetli olan, evlerimizde bileşik formatında nacl olarak yani "sofra tuzu" olarak bulundurduğumuz, oysaki saf metal halinde nükleer tesislerin vazgeçilmesi olan sodyum elementinin hikayesi ilginçtir. evet birçoğu farkında olmasa da "sodyum" bir metaldir...
peki sodyum üretimi neden zahmetlidir?
sodyum (ve benzeri elementler diyerek genişletelim) doğada neden saf halde bulunmaz? hatta laboratuvar ortamında oksijenin ve nemin olmadığı ortamda tutulmak zorundadır?
sodyum, alkali metal sınıfında 1a grubunda su ve hava ile hızlı şekilde reaksiyona giren sünek bir elementtir. kimyada basit bir kural vardır, "kolay elektron verebilen metaller doğada saf halde bulunmaz." bu iyonlaşma enerjisiyle açıklanır, periyodik cetvelde sağdan sola, yukarıdan aşağıya inildikçe iyonlaşma enerjisi azalır yani elementler kolay elektron verir. bu duruma en yatkın grup ise 1a'dır. (hatta 1a grubunda benzer yukarıdan aşağı inildikçe yeryüzünde bulunma ihtimallerinin de azaldığını görürüz. )
konumuza geri dönelim. bu element oğada saf bulunmaz çünkü iyonlaşma enerjisi çok düşüktür. elektron alma isteği yüksek bir element gördüğü anda reaksiyon yapar. ne mutlu ki dünyada bunu gerçekleştirebilecek önemli bileşikler mevcut oksijen ve su molekülleri.

bu zor metali nasıl üretiyoruz?
bu metal genellikle tuz formatında (nacl) bileşik halinde yeryüzünde %2,8 oranında bulunur. üretimi elektroliz hücresinde gerçekleşir, popüler metaller gibi ergitilerek üretilemez çünkü kloru sodyum elementi bileşiğinden kopartabileceğiniz affinitesi daha yüksek bir element yok gibidir, olanlar da pratik değildir çünkü kendileri de doğada çok az miktarda bulunurlar.
kısacası üretimi elektroliz ile kendi tuzunda gerçekleşir fakat tuzun ergime sıcaklığı 800°c olduğu için ve sodyum 882.9 °c kaynadığı için üretim esnasında ciddi bir sis yaratır. bu sebeple ergime sıcaklığı düşürülmelidir. bu amaçla cacl2 tuzu da sisteme eklenir ve ergime sıcaklığı 600°c düşürülür, böylece hem sisle sodyum kaybı engellenmiş hem de enerjiden kazanç yaratılmış olunur.
sodyum her durumda kalsiyumdan daha kolay elektron verdiği için katotta toplanır. dışarıya ise cl2 gazı (klor gazı) verilir, bu gaz tehlikelidir ve bacadan toplanarak asit yapımı için değerlendirilebilir. toplanan sodyum sıvı haldedir ve oksitlenmemesi için hava ve nem ile teması olmamalıdır.

nerede kullanılır?
öğrendiklerimizden şu sonucu çıkartabiliriz. sodyum açık atmosferde hızlıca reaksiyona girerek yanar. demek ki günlük kullanımda bir yeri yoktur, hatta benzer özellikte lityum, potasyum vb. 1a ve 2a grubu elementlerin de aynı sebepten yok denecek kadar azdır.
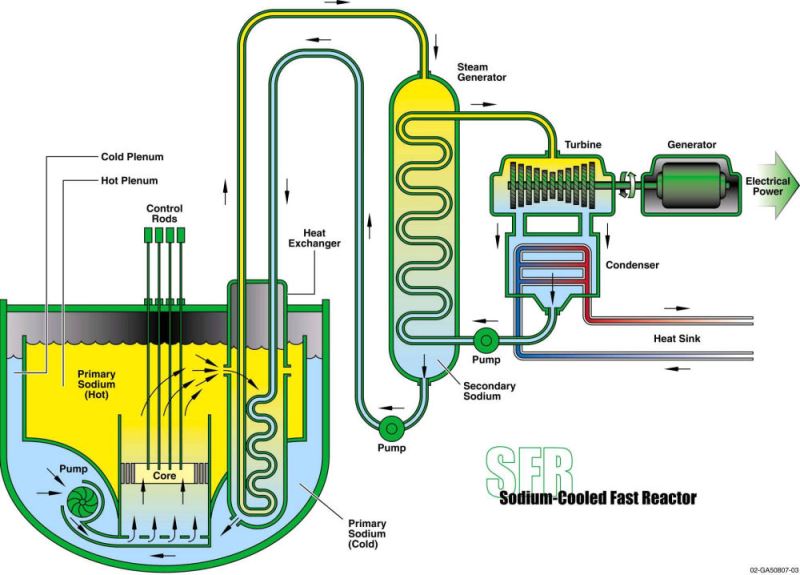
sodyumun en önemli kullanım alanı nükleer reaktörlerdir. "sodium-cooled fast reactor (sfr)", yani sodyum soğutmalı hızlı reaktörlerde soğutma elemanı olarak kullanır. tabii ki bunun yapılabilmesi için oksijen ve havadan uzak kapalı bir devrede olması gerekmektedir.
geçmişte bu reaktörlerde su kullanılırdı fakat suyun bazı negatif tarafları mevcuttu. suyun nşa'da 100 °c üstünde buharlaştığını görüyoruz. aynı zamanda güçlü bir "nötron yavaşlatıcıdır." suyun kimyasal yapısındaki hidrojen hafif bir elementtir ve çarpışma esnasında nötronla etkileşime geçer. kısacası çarpışmaları yavaşlatır ve verimi düşürür. oysa ki sodyum'un böyle bir problemi yoktur. (fast reactor ismi buradan gelmektedir.)

oysaki sodyum metalinin öz kütlesi sudan bile düşüktür (0.971 suyun üstünde yüzer), bu daha az hacim kaplamasını sağlar. ergime noktası 97,81°c, kaynama noktası 882,3 °c'dir ve ısıyı çok iyi iletir. çalışma aralığı suya göre geniştir. su, sodyuma göre yüksek ısıyı üstünde taşıyabilse de 100°c kaynar ve sodyumun ısı iletimi daha iyidir. su basınçlı kullanılması gerekirken sodyumda bu ihtiyaca gerek yoktur. sodyum, çelik reaktörü korozyona uğratmaz ve elektriksel olarak iletken olması sebebiyle elektromanyetik pompalar tarafından pompalanabilir.
bu sebeplerle kolaylıkla suyada göre daha yüksek miktarda ısıyı kullanılabilir hale getirebilir. örneğin su soğutmalı sistemler de nükleer reaktör 100 mw/m3 güç üretilebilirken, sodyum soğutmalı sistemde 3 katına ulaşabilmektedir. şurada ısı değiştiricinin ısıyı ve buharı sistemden alarak nasıl elektrik enerjisine çevirdiği üstüne dair görsel bir gösterim mevcut:
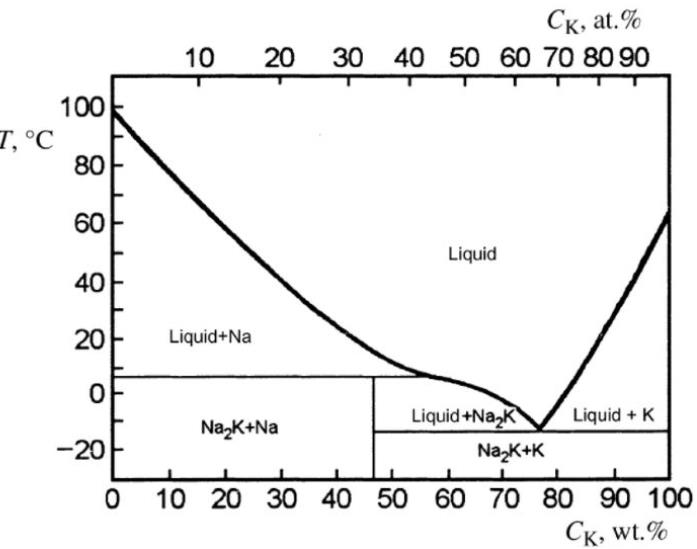
bazen bu ergiyiğe özellikleri benzer olan hemen atında bulunan potasyum da katılıp alaşım yapılabilmektedir. %22 civarı sodyum katıldığında oluşan ürün ötektik olur ve ergime sıcaklığı yaklaşık -15°c'lara düşer. amacımız zaten sıvı ürün elde etmek olduğu için işimize gelir.
na-k faz diyagram:
sodyumun ısı değiştirici olarak kullanılmasında 2 temel problem vardır. 1.si nötronla nükleer karakter kazanabilir ve 15 sa yarılanma ömrüne sahip olur. hava ile temas ederse hali hazırda soğutmaya çalıştığımız reaktörde yanıcı bir reaksiyon verir ve bu da büyük bir tehlikedir.
görüldüğü gibi sodyum dediğimiz metal kendi başına bir hikayeler bütünüdür.
kaynaklar:
1. https://www.britannica.com/science/sodium
2. http://www.dynamicscience.com.au/…dox/downscell.htm
3. http://large.stanford.edu/…urses/2018/ph241/rojas1/
4. https://en.wikipedia.org/…odium-cooled_fast_reactor